Trendscout
Auf zu neuen Ufern!
Die moderne Krebstherapie: Neue Entdeckungen im Kampf gegen Krebs
Krebs – eine Erkrankung, die uns im Bann hält wie keine andere. Statistisch gesehen erkrankt bis zu jeder zweite Mensch in Deutschland im Laufe seines Lebens an Krebs.1 Dabei hat Krebs auf den ersten Blick nicht viel Gemeinsamkeiten mit dem kleinen Schalentier mit dem er seinen Namen teilt, sondern ist vielmehr wie ein großes und scheinbar unbezwingbares Seeungeheuer.
Davon lässt sich die moderne Krebstherapie jedoch nicht abschrecken! Seit Jahren kommen stetig neue Behandlungsoptionen dazu – etwa jede 4. der erwarteten Neuzulassungen in diesem Jahr war eine Antitumor-Therapie.2 Doch wohin gehen die neuen Strömungen in der Therapieentwicklung und welche bislang unbekannten Flecken auf der Landkarte, konnte die Tumorforschung inzwischen aufdecken, um sich gegen den Krebs zu wappnen? Diese und weitere Fragen standen auch auf der diesjährigen Tagung der Deutschen Gesellschaft für Hämatologie und Onkologie (DGHO) im Mittelpunkt.
volle fahrt voraus: immuntherapie gegen krebs
Um das Arsenal an Krebstherapie zu verbessern, haben sich zahlreiche Forschende in den letzten Jahren und Jahrzehnten auf Entdeckungsreise begeben. Eine besondere Erfolgsgeschichte dabei ist die der personalisierten Methoden, mit dem Ziel das Immunsystem der Patient*innen bei der Krebsabwehr zu unterstützen. Dazu gehören unter anderem die Immuncheck-Inhibitoren Sie verhindern, dass sich Krebszellen durch sogenannte Immuncheckpoints auf ihrer Oberfläche vor dem Immunsystem verstecken. Immuncheckpoint-Inhibitoren sind vielseitig: ein Medikament kann übergreifend für verschiedene Tumorentitäten eingesetzt werden. In Zukunft werden zunehmend Zulassungen unabhängig von der Art des Tumors erwartet.3 Hohe Ansprechraten der Krebsimmuntherapie von bis zu 87 % je nach Tumorentität4 versprechen ebenfalls guten Wind und freie Fahrt. Zudem hat sich der Anteil der Patient*innen, die für eine solche Krebsimmuntherapie in Frage kommen zwischen 2011 und 2018 fast verdreißigfacht5,6 – Schätzungen gehen davon aus, dass in den USA inzwischen bereits 36–38 % der Krebspatient*innen geeignet sind.6
flotte aufrüsten: weiterentwicklung von car-t-zellen
Die CAR-T-Zellen sind ebenfalls ein Flaggschiff in der Flotte der modernen Krebstherapie. Die körpereigenen Immunzellen werden gentechnisch verändert, um sie im Kampf gegen Krebs zu stärken und zeigten bereits beeindruckende Wirksamkeit bei stark vorbehandelten Patient*innen mit malignen hämatologischen Erkrankungen.7 Nachdem die ersten gegen CD19-gerichtete Therapien seit einigen Jahren zugelassen sind, wurde jedoch beobachtet, dass es bei 30–50 % der Patient*innen zu einem Rückfall kommen kann.8 Ein wichtiger Mechanismus dabei ist die Runterregulation bzw. Modulation des Ziels CD19, welches die Immunzellen auf der Oberfläche der Krebszellen erkennen. Dadurch geht das Angriffsziel verloren und die Therapie verliert ihre Wirkung.
Prof. Dr. med. Martin Wermke, Dresden, stellte auf dem DGHO mögliche Gegenansätze vor:9,10
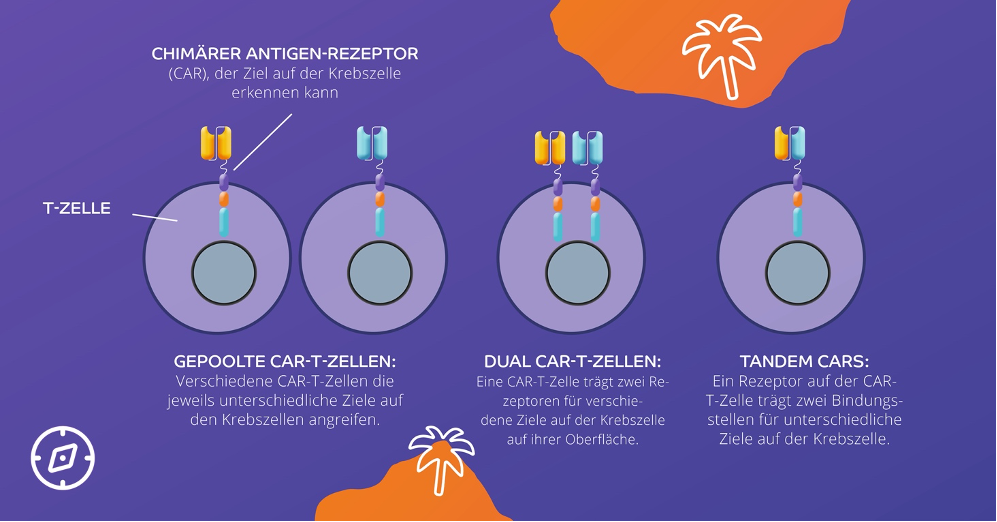
In Zukunft könnten solche Weiterentwicklungen helfen, die Resistenzmechanismen von Krebszellen zu umgehen, weil nicht nur ein Ziel angegriffen wird. Das macht die Entwicklung von Resistenzen schwieriger. Wichtig ist dabei jedoch, dass für die verschiedenen Ziele eine gleich hoher Affinität besteht, damit kein erneuter Resistenzdruck entsteht.9
Moderne technik: selbstzerstörungsmechanismus als rettungsring
Eine andere Art der Weiterentwicklung besteht darin, die CAR-T-Zelltherapie noch sicherer zu machen. Im Falle einer schwerwiegenden Nebenwirkung, die sich nicht durch zusätzliche Medikation eindämmen lässt, sollte eine Therapie natürlich sofort abgesetzt werden. Doch was, wenn die Behandlung länger im Körper verbleibt, wie etwa bei den CAR-T-Zellen? Auch mit dieser Frage beschäftigt sich die aktuelle Forschung. So gibt es beispielsweise den Ansatz, die genetisch modifizierten T-Zellen zusätzlich zu einem zielgerichteten Antigenrezeptor, der die Krebszellen erkennt, auch mit einer „Selbstmordsequenz“ auszustatten.9,11 Was dramatisch klingt, ist vielmehr ein Rettungsring: Sobald per Infusion eine bestimmte Komponente zugesetzt wird, kommt es in den CAR-T-Zellen zum eingeleiteten Zelltod. Die CAR-T-Zelltherapie soll somit schnellstmöglich aus dem Körper entfernt werden, um mögliche Komplikationen zu verhindern.
frischer wind in den segeln: metabolismus von immunzellen ankurbeln
Ein weiterer Ansatz die modernen Krebstherapie aufzurüsten besteht darin, den Metabolismus der Tumor- und Immunzellen auszunutzen und zu instrumentalisieren. Prof. Dr. med. Dimitrios Mougiakakos, Magdeburg, stellte auf dem DGHO gleich mehrere Optionen dafür vor. Bei den meisten bewegen sich die Forschenden noch in unbekannten Gewässern – bis zum Einsatz in der Klinik wird es noch dauern. Ein Ansatz wird jedoch bereits durch zugelassene Immuncheckpoint-Inhibitoren genutzt, welche die Oberflächenmoleküle PD-L1 oder PD-1 blockieren. Der Mechanismus dahinter wird allerdings erst jetzt mehr und mehr beleuchtet. PD-L1 und PD-1 können den Tumor vor Immunzellen verbergen. Die Blockade durch eine Krebsimmuntherapie führt zum einen dazu, dass das Immunsystem die Krebszellen wieder aufspüren kann. Zum anderen boostert sie aber auch den Metabolismus der Immunzellen, der zuvor heruntergefahren wurde. So hat das Immunsystem wieder frischen Wind in den Segeln, um besonders gut gegen den Krebs vorgehen können.12
land in sicht?
Dank der zahlreichen modernen Krebstherapien sind inzwischen viele Tumorarten wie etwa das Multiple Myelom13 zu chronischen Erkrankungen geworden. Mit ihnen können die Betroffenen teilweise jahrelang leben, selbst wenn es (noch) keine Heilung gibt. Mit den weiteren Entwicklungen wird das in Zukunft wohlmöglich bei noch mehr Entitäten der Fall sein. Das Schiff ist also noch nicht in den sicheren Hafen eingelaufen und Krebs ist keinesfalls besiegt. Wohin die Reise geht, bleibt letztlich abzuwarten, aber dank der neuen Entdeckungen und Entwicklungen ist am Horizont Land in Sicht.
Referenzen:
- Bayrische Krebsgesellschaft. Wie häufig ist Krebs?, unter: https://www.bayerische-krebsgesellschaft.de/informationen/fakten-ueber-krebs/wie-haeufig-ist-krebs/?L=0 (zuletzt aufgerufen: 18.11.2022).
- Medizin 2022: Mehr als 45 neue Medikamente erwartet. Pressemitteilung 025/21, unter: https://www.vfa.de/de/presse/pressemitteilungen/pm-025-2021-ueberschrift.html (zuletzt aufgerufen: 18.11.2022).
- Rodes Sanchez M, Henderson N, Steuten L, 2020. Bridging the Gap: Pathways for Regulatory and Health Technology Assessment of Histology Independent Medicines. OHE Consulting Report, London: Office of Health Economics, unter: https://www.ohe.org/news/bridging-gap-pathways-regulatory-and-health-technology-assessment-histology-independent-cancer (zuletzt aufgerufen: 18.11.2022).
- Darvin P et al. Immune checkpoint inhibitors: recent progress and potential biomarkers. Exp Mol Med. 2018;50(12):1–11.
- Haslam A, Prasad V. Estimation of the Percentage of US Patients With Cancer Who Are Eligible for and Respond to Checkpoint Inhibitor Immunotherapy Drugs. JAMA Netw Open. 2019;2(5):e192535.
- Haslam A, Gill J, Prasad V. Estimation of the Percentage of US Patients With Cancer Who Are Eligible for Immune Checkpoint Inhibitor Drugs. JAMA Netw Open. 2020;3(3):e200423.
- Westin JR et al. Efficacy and safety of CD19‐directed CAR‐T cell therapies in patients with relapsed/refractory aggressive B‐cell lymphomas: Observations from the JULIET, ZUMA‐1, and TRANSCEND trials. Am J Hematol. 2021;96(10):1295–1312.
- Shah NN, Fry TJ. Mechanisms of resistance to CAR T cell therapy. Nat Rev Clin Oncol. 2019;16(6):372-385
- Wermke M. Next Generation zelluläre Immuntherapie in der Hämatologie – was kommt nach den etablierten CD19 CARTs? Wissenschafliches Symposium, DGHO 2022, Wien, Österreich.
- Safarzadeh Kozani P, Safarzadeh Kozani P, O’Connor RS. In Like a Lamb; Out Like a Lion: Marching CAR T Cells Toward Enhanced Efficacy in B-All. Mol Cancer Ther. 2021;20(7):1223-1233.
- Minagawa K, Al-Obaidi M, Di Stasi A. Generation of Suicide Gene-Modified Chimeric Antigen Receptor-Redirected T-Cells for Cancer Immunotherapy. Methods Mol Biol. 2019;1895:57–73.
- Rivera GOR et al. Fundamentals of T Cell Metabolism and Strategies to Enhance Cancer Immunotherapy. Front Immunol. 2021;12:645242.
- Derman B, Jakubowiak A. Moving toward a cure in multiple myeloma: Eradication of measurable residual disease. Adv in Oncol. 2022;2(1);159–169.
